Ranking de los mejores blogs de 9B.
Los tres mejores blogs son:
1. saraclaseinformatica.blogspot.com, puesto que la temática escogida es muy adecuada, no necesariamente porque yo sea mujer, sino que el tema es muy inclusive para cualquier público, además, los gráficos son llamativos.
2. interesespara.blogspot.com, debido a que el deporte es uno de los aspectos importantes que componen la vida del ser humano y es uno de los complementos necesarios para conservar una excelente salud.
3. cuidatusaludconnoom.blogspot.com ya que instruye sobre la alimentación que debe tener el ser humano para poseer una corpulencia adecuada y una salud balanceada.
¿Qué te parece mi blog?
jueves, 28 de agosto de 2014
jueves, 31 de julio de 2014
COMPUESTOS POLARES Y APOLARES
La polaridad de las moléculas.
Una gran parte de las sustancias que nos rodean no están formadas por moléculas que andan "vagando" en el espacio a cualquier distancia entre ellas, si usted toma un poco de agua, el "cuerpo" se mantiene como una unidad volumétrica que no se deshace ni crece de volumen espontáneamente. Del mismo modo sucede con el tetracloruro de carbono CCl4 (un líquido disolvente), con el hielo y otras muchas sustancias que nos rodean. Esta situación de coherencia nos induce a pensar que deben existir fuerzas de atracción entre las moléculas que las mantienen unidas en un cierto volumen fijo, y el hecho es absolutamente cierto para líquidos y sólidos. En los gases esto no se cumple, las moléculas de los gases si "vagan" sin ser retenidas por nada (o casi nada) y por lo tanto un gas dejado en el espacio (sin estar en un recipiente) se expande constantemente auto-diluyéndose, es decir sus moléculas se separan unas de otras sin control, parece que no hay fuerzas de atracción intermoleculares o estas son muy débiles.Si usted toma un trozo de hielo y trata de partirlo con las manos notará una fuerte resistencia, probablemente no podrá romperlo, sus moléculas están fuertemente unidas por interacción molecular, de no haberla resulta claro que el trozo de hielo se convertiría en gas al instante.
Pero ¿de donde vienen esas fuerzas intermoleculares?, ¿de qué depende la magnitud de estas? Un rol clave en esto se encuentra en la forma de las moléculas.
Moléculas polares y apolares
Analicemos dos moléculas simples, la de hidrógeno H2 y la de fluoruro de hidrógeno HF (un gas). Ambas tienen forma lineal (todas las moléculas con solo dos átomos son lineales) pero entre ellas hay una gran diferencia.| La molécula de hidrógeno está formada por dos átomos de este elemento unidos por un enlace covalente puro, es decir ambos átomos comparten por igual los electrones de enlace (figura 1). Para el caso del HF la situación es distinta, el átomo de flúor al ser mas electronegativo (tabla 1) que su "compañero" el hidrógeno retiene mas tiempo en sus cercanías los electrones compartidos y el enlace resulta covalente polar (figura 2). ¿Que sucede con esto?, simplemente que hay una mayor concentración de carga negativa en las inmediaciones del átomo de flúor, y por la misma razón una mayor presencia de carga positiva alrededor el átomo de hidrógeno, la molécula se polariza eléctricamente. En la práctica este desbalance de cargas se representa con la letra griega minúscula delta (δ) y en la inmediaciones del átomo de flúor existe una carga δ+ mientras que alrededor de átomo de hidrógeno una carga δ-. La polaridad de las moléculas de gases no es igual para todos, ya hemos visto que la molécula de hidrógeno no es polar, del mismo modo no son polares las moléculas de nitrógeno y del oxígeno del aire, estos gases comparten los electrones de valencia por igual y por tanto no hay regiones cargadas en la molécula. En el HF la significativa diferencia de eletronegatividad entre el hidrógeno y el flúor resulta en una molécula bastante polarizada, más que la molécula de cloruro de hidrógeno HCl veamos porqué. Observe la tabla 1 a la derecha, verá que el flúor (F) es mas electronegativo (EN = 4.0) que el cloro (Cl) con EN = 3.0, la electronegatividad es una magnitud que da idea de la fuerza con la que cierto elemento atrae para él los electrones compartidos en un enlace, de forma que la polaridad de una molécula estará en dependencia de la diferencia de electronegatividades (ΔEN) entre los átomos involucrados. Así tenemos que: La molécula de HF tiene ΔEN = 4.0 - 2.1 = 1.9 La molécula de HCl tiene ΔEN = 3.0 - 2.1 = 0.9 Ambas moléculas son polares pero la de HF es más polar de la de HCl. La polaridad de las moléculas se puede tratar como una magnitud vectorial, tiene un valor (que depende de ΔEN) y convencionalmente se le ha dado el sentido hacia δ- con una cruz del lado de δ+ tal y como se representa en las figuras 3 y 4 a continuación.
Note que hemos usado el concepto de momento dipolar para el enlace, pero también hay un momento dipolar para la molécula en conjunto que se llamamomento dipolar molecular. Para las moléculas tratadas hasta ahora donde solo hay un enlace polar, evidentemente el momento dipolar del enlace es el mismo que el momento dipolar de la molécula. Veamos ahora el acetileno como ejemplo de una molécula con mas de un enlace polar.  Note que en el acetileno tiene dos enlaces polares C-H y esto se puede detectar de la diferencia de electronegatividades entre ambos elementos, la EN del carbono es 2.5 mientras que la del hidrógeno es 2.1 lo que produce un ΔEN = 0.4 indicando un momento dipolar del enlace no muy alto, el enlace no es muy polar, pero es polar al fin. Además hay un enlace triple C-C que como es entre átomos iguales no es polar (ambos comparten los electrones del enlace por igual). Hagamos ahora el diagrama vectorial de la molécula del acetileno (figura 12 a continuación).  Figura 12. Diagrama de la molécula del acetileno mostrando los vectores de momento dipolar |  Figura 1. Enlace H-H covalente puro  Figura 2. Enlace H-F covalente polar  Tabla 1. Electronegatividad de los elementos representativos. |
Un caso interesante es el del agua, esta es una molécula con tres átomos, dos de hidrógeno y uno de oxígeno cuya forma molecular se muestra en la figura 13 a la derecha. Esta molécula es del tipo acodada y todos sus átomos están en el mismo plano. Calculemos ahora la ΔEN de los enlaces H-O como la diferencia entre las electronegatividades de ambos elementos. ΔEN = 3.5 - 2.1 = 1.4 (vea la tabla 2) La magnitud de ΔEN es relativamente grande (el oxígeno es el segundo entre los elementos mas electronegativos) lo que significa que el momento dipolar del enlace es alto y por tanto muy polarizado. Construyamos el diagrama vectorial de la molécula del agua según la convención establecida con anterioridad para determinar si la molécula en su conjunto es polar o apolar. |  Figura 13. Molécula del agua |
La figura 5 a la derecha muestra la construcción del diagrama vectorial para determinar la polaridad de la molécula de agua. Note que efectivamente la suma de los vectores correspondientes a los momentos dipolares de cada enlace resulta en un vector con cierta magnitud (comparable con la del fuerte enlace polarizado H-O) y que este se dirige cortando el ángulo entre los átomos de hidrógeno a la mitad, o dicho de otra forma desde el lado δ+ de la molécula como un todo, hacia el lado δ- de la molécula como un todo según se muestra a continuación en la figura 6.  |
VIRUS
Introducción
Las dos características fundamentales que presentan los virus son: su composición simple y su forma de multiplicación especial, siendo ambas propiedades determinantes de su parasitismo intracelular obligado.La partícula viral madura, denominada virión consiste básicamente de un bloque de material genético rodeado de proteínas que lo protegen del medio ambiente y le sirven como vehículo para permitir su transmisión de una célula a otra. Esta estructura puede presentar mayor o menor grado de complejidad.
Estructura y organización de las partículas virales

Los virus más pequeños y simples están constituidos únicamente por ácido nucleico y proteínas. El ácido nucleico es el genoma viral, ubicado en el interior de la partícula, y puede ser ADN o ARN. Generalmente está asociado con un número pequeño de moléculas proteicas que pueden tener actividad enzimática o cumplir alguna función estabilizadora para el plegamiento del ácido nucleico y armado de la partícula viral. Este conjunto de genoma y proteínas íntimamente asociadas es llamado "core", núcleo, nucleoproteína onucleoide. Este núcleo central está rodeado por una cubierta proteica, la cápside, que junto con el genoma constituye la nucleocápside. Las cápsides virales están formadas por un gran número de subunidades polipeptídicas que se ensamblan adoptando una simetría de tipo helicoidal (nucleocápside en forma de bastón) o icosaédrica (partículas casi esféricas). En algunos virus más complejos, por fuera de la cápside se encuentra otra cubierta, laenvoltura, que es una estructura membranosa constituida por lípidos y glicoproteínas. Dicha cubierta viral puede ser considerada una cubierta protectora adicional.Ácidos nucleicos virales |
Tipos de ADN virales
La mayoría de los virus ADN presentan un genoma bicatenario, con excepción de los parvovirus, constituidos por ADN monocatenario. Además las moléculas de ADN viral pueden ser lineales o circulares.La conformación circular que presentan los Papovaviridae y Hepadnaviridae, confiere una serie de ventajas al ácido nucleico respecto de la estructura lineal, otorgándole protección frente al ataque de exonucleasas, facilitando la replicación completa de la molécula y su posible integración al ADN celular. En el caso de los papovavirus, el ADN puede presentar tres conformaciones: la forma I corresponde a la molécula circular covalentemente cerrada y superenrollada sobre sí misma. Si se produce una ruptura en una unión en una de las cadenas, la doble hélice se desenrolla y resulta una molécula circular relajada (forma II). Por último, la forma III es el resultado de una ruptura en la otra cadena que origina una molécula bicatenaria lineal.
El ADN circular de los hepadnavirus tiene una estructura muy peculiar y de características únicas dentro de los ADN virales: una de las cadenas (S, corta) es incompleta, de manera que el 15-50% de la molécula es monocatenaria; la otra cadena (L, larga) presenta ruptura en un único punto de la molécula y además tiene una proteína unida covalentemente en el extremo 5`.
Tipos de ARN virales
Los ARN de los virus animales son en su gran mayoría de cadena simple, siendo Reoviridaey Birnaviridae las únicas familias que presentan como genoma ARN bicatenario. En algunos grupos de virus, el ARN genómico está segmentado en varios fragmentos, cuyo número es característico de cada familia.Además de las características físicas y químicas mencionadas, la polaridad o sentido de la cadena de ARN es una propiedad fundamental utilizada para definir los distintos tipos de ARN viral. Se parte de definir como polaridad positiva la secuencia de bases correspondiente al ARNm y polaridad negativa a la secuencia complementaria a la del ARNm. Un virus es de cadena positiva cuando su ARN genómico tiene la polaridad que le permite actuar como ARNm, o sea ser traducido en proteínas, inmediatamente después de haber entrado a la célula.
Por el contrario, en los virus de polaridad negativa el ARN genómico tiene la secuencia complementaria al ARNm viral; por lo tanto, cuando se produce la infección y el ARN viral entra en la célula debe sintetizar la cadena complementaria que será el ARNm. Para ello, los virus de polaridad negativa llevan en el virión asociada a su genoma una ARN polimerasa dependiente de ARN, enzima denominada transcriptasa, que efectúa la transcripción del ARN mensajero a partir del ARN genómico.
Cápsides |
Hay dos tipos básicos de estructura que pueden presentar las cápsides virales: simetríaicosaédrica, observándose el virión al microscopio de forma aproximadamente esférica, osimetría helicoidal, resultando nucleocápsides filamentosas tubulares pero que pueden estar encerradas dentro de una envoltura que confiere a la partícula forma esférica o de bastón.
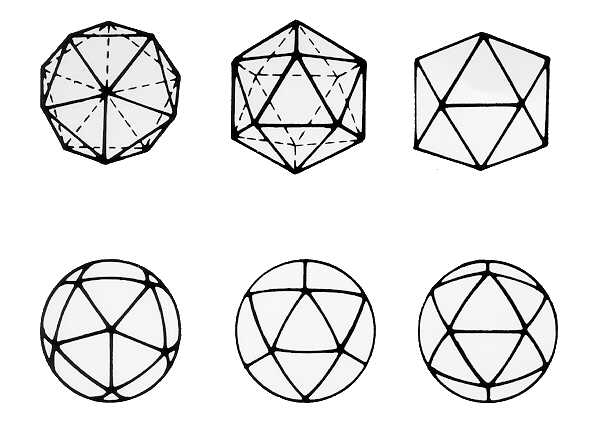 |
| Simetría icosaédrica: El icosaedro es un poliedro de 20 caras triangulares equiláteras con 12 vértices. Presenta simetría rotacional 5.3.2, por lo que tiene 6 ejes de simetría quíntuple que pasan a través de pares de vértices opuestos; 10 ejes de simetría triple que pasan a través del centro de las caras, y 15 ejes de simetría binaria, a través de los puntos medios de las aristas. |
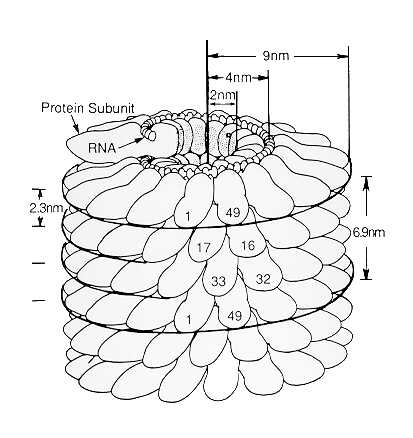 |
Envolturas |
Los virus adquieren su estructura mediante un proceso de brotación a través de alguna membrana celular. El número de glicoproteínas que presentan los virus animales es muy variable.
Las glicoproteínas virales que forman las espículas son proteínas integrales de membrana que atraviesan la bicapa de lípidos presentando tres dominios topológicamente diferenciables: 1) un gran dominio hidrofílico hacia el exterior de la membrana; 2) un pequeño dominio hidrofóbico formado por 20-27 aminoácidos que atraviesa la capa lipídica y ancla la glicoproteína a la membrana; 3) un pequeño dominio hidrofílico hacia el interior de la partícula viral. Este último dominio interactúa con las proteínas de la nucleocápside, ya sea directamente o a través de una proteína viral no glicosilada denominada M (de matriz), que se encuentra en algunos virus animales por debajo de la bicapa.
Las glicoproteínas virales cumplen diversas funciones biológicas durante el ciclo de vida de un virus, siendo esenciales para la infectividad, ya que actúan: 1) en la adsorción a la célula huésped; 2) en el proceso de fusión que permite la entrada de la nucleocápside viral al citoplasma; 3) en la brotación, que permite la salida del virus envuelto a partir de la célula infectada. Además las glicoproteínas son el blanco de reacción para el sistema inmune tanto en la respuesta humoral como celular.
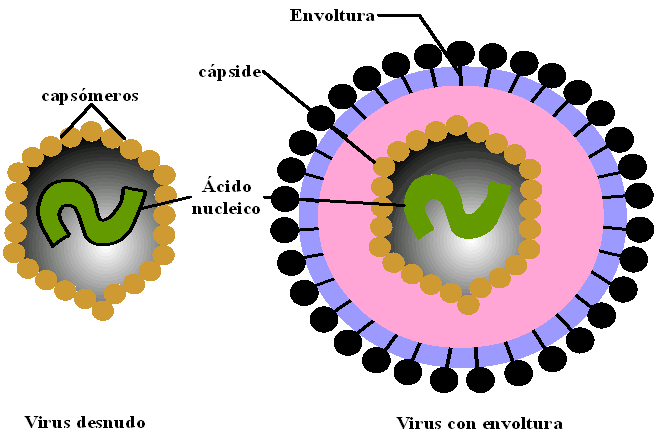 |
Nomenclatura
El nombre de los virus obedece a distintas consideraciones. Algunas veces se debe a la enfermedad que ellos producen, por ejemplo el virus polio se llama así porque produce la poliomielitis. También puede deberse al nombre de los descubridores como el virus del Epstein-Barr, o a características estructurales de los mismos como los coronavirus. Algunos poseen un nombre derivado del lugar donde se los halló por primera vez, tal es el caso del virus Coxsackie o Norwalk.El ICTV (International Committee on taxonomy of viruses) ha propuesto un sistema universal de clasificación viral. El sistema utiliza una serie de taxones como se indica a continuación:
Orden (-virales)
|
- Orden Mononegavirales
- Familia Filoviridae
- Género Filovirus
- Especie: Ebola virus Zaire
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
VIRUS ARN
| |||
Familia
|
Género
|
Ejemplo
|
Comentario
|
Picornaviridae
|
Entero-virus
|
Polioviruses
|
3 tipos; meningitis aséptica, poliomielitis paralítica
|
Echoviruses
|
32 tipos; Aseptic meningitis, rashes
| ||
Coxsachieviruses
|
29 types; meningitis aséptica, miopericarditis
| ||
Hepato-virus
|
Virus de la
Hepatitis A
|
Hepatitis aguda (propagación fecal-oral)
| |
Rhino-virus
|
Human rhinoviruses
|
115 tipos; Resfríado común
| |
Caliciviridae
|
Calici-virus
|
Norwalk virus
|
Enfermedad gastrointestinal.
|
Hepe-virus
|
Virus de la
Hepatitis E
|
Hepatitis aguda (propagación fecal-oral)
| |
Paramyxoviridae
|
Paramyxo-virus
|
Parainfluenza viruses
|
4 tipos; Resfríado común, bronquiolitis, neumonía
|
Rubula-virus
|
Virus de las Paperas
|
Paperas: parotitis, meningitis aséptica (raro: orquitis, encefalitis)
| |
Morbilli-virus
|
Virus del sarampión
|
Sarampión: fiebre, exantema (raro: encefalitis, SSPE)
| |
Pneumo-virus
|
Virus Sincitial respiratorio
|
Resfríado común(adultos), bronquiolitis, neumonia (niños)
| |
Orthomyxoviridae
|
Influenza-virus A
|
Influenza virus A
|
Flu: fiebre, mialgias, malestar general, tos, neumonia
|
Influenza-virus B
|
Influenza virus B
|
Flu: fiebre, mialgias, malestar general, tos, neumonia
| |
Rhabdoviridae
|
Lyssa-virus
|
Virus de la Rabies
|
Rabia: incubación larga y después enfermedad del SNC y muerte.
|
Filoviridae
|
Filo-virus
|
Virus de
Ebola and Marburg
|
Fiebre hemorrágica, muerte
|
Bornaviridae
|
Borna-virus
|
Borna disease virus
|
No muy claro; relacionado con enfermedades tipo:ezquizofrenia en algunos animales.
|
Retroviridae
|
Onco-virinae
|
Human T-lymphotropic virus type-1
|
Leucemia de células T del adulto. (ATL), paraparesia espástica tropical (TSP)
|
Spuma-virinae
|
Human foamy viruses
|
No se conoce patología
| |
Lenti-virinae
|
Virus type1 y 2 de la inmunodeficiencia humana
|
SIDA, enfermedad del SNC
| |
Togaviridae
|
Rubi-virus
|
Virus de la Rubeóla
|
Exantema; malformaciones congénitas.
|
Alpha-virus
|
Virus de la Encefalitis equina (WEE, EEE, VEE)
|
Transmitida por mosquitos, encefalitis
| |
Flaviviridae
|
Flavi-virus
|
Virus de la Fiebre Amarilla
|
Mosquito-born; fever, hepatitis (yellow fever!)
|
Virus del Dengue
|
Transmitida por mosquitos; hemorrhagic fever
| ||
Virus de la Encefalitis de San Luis
|
Transmitida por mosquitos; encephalitis
| ||
Hepaci-virus
|
Virus de la
Hepatitis C
|
Hepatitis (con frecuencia: crónica), cáncer hepático
| |
Reoviridae
|
Rota-virus
|
Rotaviruses Humano
|
6 tipos; Diarrea
|
Colti-virus
|
Virus de la Fiebre de Garrapatas de Colorado
|
Transmitido por garrapatas; fiebre
| |
Ortho-reovirus
|
Reoviruses Humanos
|
Enfermedad leve
| |
Bunyaviridae
|
Hanta-virus
|
Síndrome Pulmonar por Hantavirus
|
Propagado por roedores; enfermedad pulmonar (puede ser letal, Ej brote de las "4 esquinas")
|
Hantaan virus
|
Propagado por roedores; fiebre hemorrágica con síndrome renal.
| ||
Phlebo-virus
| |||
Suscribirse a:
Entradas (Atom)

